Caso Clinico:
Ematoma intracerebrale da fissurazione di un
aneurisma
gigante intracranico simulante trombosi intraluminale
Presentato dal Dott. Paolo Perrini e dal Dott. A.
Scollato
Il paziente, maschio di 69 anni, in relazione alla improvvisa comparsa di
cefalea violenta seguita da perdita di coscienza, veniva sottoposto a TC cranio
diretta presso altro Ospedale che rilevava una voluminosa lesione temporale
destra, leggermente iperdensa centralmente, circondata da alone iperdenso a
semiluna , con effetto massa sul peduncolo cerebrale omolaterale e suggestiva di
un aneurisma gigante con trombosi massiva intraluminale (Fig. 1).
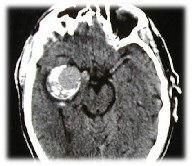
|
Figura 1: Immagine TC
assiale diretta. L'aneurisma appare caratterizzato da un'area circolare di lieve
iperdensità circondata da un'iperdensità a semiluna di grado maggiore. Da notare
l'assenza di ESA e la compressione sul peduncolo cerebrale destro che giustifica
la sindrome alterna. |
All'esame obiettivo neurologico eseguito all'ingresso presso il nostro
reparto, il paziente si presentava in grado III di Hunt ed Hess mostrandosi
soporoso ma risvegliabile allo stimolo verbale e presentando una emiparesi
brachio-crurale sinistra con ptosi palpebrale destra (sindrome alterna di
Weber). Instaurata terapia con nimodipina e.v., il giorno successivo al ricovero
il paziente veniva sottoposto ad esame RMN encefalo (0,2 tesla), che evidenziava
la presenza di sanguinamento perilesionale recente (iperintensità perilesionale
in T1) e mostrava l'aneurisma gigante con notevole disomogeneità di segnale
facendo supporre la presenza di fenomeni trombotici intraluminali (Fig 2).
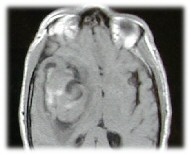
|
Figura 2:
Immagine RMN assiale T1 pesata (TR 476.0, TE 15.0). L'aneurisma presenta un'area
di assenza di segnale (signal void) corrispondente al flusso rapido e un'area
isointensa con il parenchima cerebrale. Da notare l'iperintensità perilesionale
indicativa di sanguinamento recente |
Lo studio angiografico cerebrale documentava invece un aneurisma gigante del
tratto M1 dell'arteria cerebrale media di destra senza segni di trombosi
intraluminale (Fig 3).
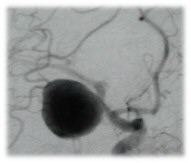
|
Figura 3: Angiografia carotide comune destra AOD che documenta
un aneurisma gigante del tratto M1 dell'arteria cerebrale media in assenza di
immagini di minus indicative di fenomeni di trombosi
intraluminale. |
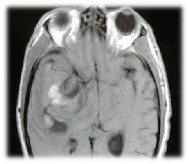
|

|
Figura 4a e 4b: Immagine RMN assiale T1 pesata (TR 476.0, TE
15.0) e disegno raffigurante i fenomeni di flusso lento all'interno della sacca
aneurismatica. Le frecce indicano il flusso all'interno dell'aneurisma con
stravaso amatico perianeurismatico tramite una fissurazione di parete che
permette l'accrescimento della lesione che assume quindi il comportamento di un
processo occupante spazio. |
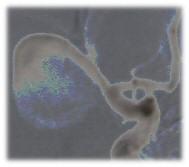
|
Figura 5: Supersolarizzazione dell'esame angiografico. Si
osserva il flusso in fase precoce di riempimento della sacca aneurismatica che
appare distribuirsi in modo uniforme sulle pareti e nel
lume. |
A distanza di 60 ore dall'insorgenza della sintomatologia il paziente fu
sottoposto ad intervento chirurgico condotto mediante craniotomia pterionale
destra e successsiva polectomia temporale omolaterale con visualizzazione ed
evacuazione di voluminoso ematoma intracerebrale. Esposta la carotide, il tratto
A1 della cerebrale anteriore e il tratto M1 della cerebrale media sia a monte
che a valle dell'aneurisma. Previo un trapping temporaneo dell'arteria cerebrale
media è stata quindi aperta la sacca aneurismatica che appariva di diametro
massimo di 3,5 cm e priva di coaguli al suo interno. La ricostruzione
dell'arteria è stata condotta mediante due clip curve in tandem con completa
esclusione della sacca aneurismatica.
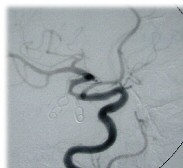
|
Figura 6: Angiografia cerebrale di controllo. Si nota la
ricostruzione del tratto M1 della MCA mediante due clip poste in
tandem. |
Il decorso post-operatorio è stato caratterizzato inizialmente da una
stabilità del quadro neurologico preoperatorio e dopo sette giorni
dall'intervento si è avuto un progressivo miglioramento del quadro neurologico
con recupero completo della vigilanza e parziale della motilità volontaria
all'emisoma sinistro.
Al momento della dimissione, in ventisettesima giornata dall'intervento, si
apprezzava lieve ptosi palpebrale destra ed emiparesi brachio-crurale sinistra,
che ad un controllo clinico ad un mese dalla dimissione era obiettivabile solo
alle manovre controresistenza.
Discussione
Gli aneurismi giganti, ovvero con maggior diametro superiore a 25 mm,
costituiscono il 3-5 % di tutti gli aneurismi intracranici e si rendono
manifesti per emorragia subaracnoidea, effetto massa o per sintomi di
tromboembolia distale. Il caso clinico presentato permette di affrontare il
problema diagnostico e terapeutico di queste lesioni vascolari che in relazione
a fenomeni emodinamici di rallentamento del flusso, sono particolarmente inclini
a presentare fenomeni di trombosi intraluminale. In base allo studio con TC gli
aneurismi giganti possono essere distinti in non trombotici (thin walled),
parzialmente trombotici e completamente trombizzati (3). Gli aneurismi giganti
non trombizzati sono caratterizzati, come nel caso presentato, dall'assenza di
calcificazioni periferiche, e da una densità che nelle immagini pre-mdc è
lievemente superiore al tessuto cerebrale, mentre aumenta in modo uniforme e
marcato dopo la somministrazione di mdc. Queste caratteristiche TC degli
aneurismi thin walled, qualora non siano accompagnati da emorragia
perilesionale, pongono dei problemi di diagnosi differenziale con i meningiomi.
Lo studio con RM aumenta la specificità diagnostica in relazione alla capacità
di individuare il flusso ematico. Come nel caso presentato può essere difficile
distinguere tra una trombosi parziale e la presenza di flusso lento. Gli
aneurismi parzialmente trombizzati sono caratterizzati da un'area di assenza di
segnale (signal void) in T1 e T2, dovuta al flusso ematico all'interno del lume
aneurismatico, circondata da una rima iperintensa in relazione alla
metaemoglobina libera. Il coagulo appare circondare la rima di iperintensità e
si presenta come una zona di segnale misto, con zone concentriche di
ipointensità che conseguono ai vari stadi del coagulo, ovvero all'alternarsi di
metaemoglobina ed emosiderina (1). Tuttavia, come nel caso presentato, aree con
lento flusso, presentano un segnale di intensità aumentata (paradoxical
enhancement) che sono difficilmente distinguibili da coaguli intraluminali (Fig
4a e 4b). La conoscenza preoperatoria di una parziale trombosi della sacca
aneurismatica permette al chirurgo di pianificare l'intervento, in quanto,
durante il controllo vascolare ottenuto mediante trapping del vaso afferente
l'aneurisma, la presenza di un coagulo riduce il collasso dell'aneurisma e ne
implica l'apertura per incrementare lo spazio di lavoro. Il metodo più sensibile
per la valutazione preoperatoria di una possibile trombosi intraluminale è
quindi rappresentato dall'angiografia, eventualmente modificata con tecniche di
supersolarizzazione che permettono di apprezzare la distribuzione del flusso
all'interno della sacca aneurismatica (Fig.5). La migliore opzione chirurgica
per un aneurisma gigante della circolazione anteriore, è l'esclusione della
sacca aneurismatica mediante più clip corte posizionate in serie a livello del
colletto (2). L'utilizzo di più clip permette l'attuazione di una ricostruzione
vascolare minimizzando lo scivolamento e fornendo una maggiore pressione di
chiusura rispetto ad una singola clip lunga (Fig 6). Quando il colletto
dell'aneurisma è così esteso da non permettere la ricostruzione mediante clip
sin dall'inizio, si può posizionare una grossa clip attraverso la cupola
dell'aneurisma così da avvicinare le pareti dell'aneurisma e quindi posizionare
le clip a livello del colletto eseguendo un clippaggio progressivo. Qualora
l'aneurisma non possa essere clippato per mancanza di un colletto sufficiente o
per difficoltà tecniche legate alla dissezione si può attuare un trapping
dell'aneurisma. Tale metodica è attuabile per quegli aneurismi con buon circolo
di compenso o che possono essere rivascolarizzati. L'escissione dell'aneurisma e
l'aneurismorrafia sono tecniche alternative che necessitano di ampio spazio per
attuare la sutura e di un ottimo controllo vascolare e sono attuabili anche a
livello di aneurismi della MCA.
Bibliografia
1. Atlas S. W. et al, 1987, Partially thrombosed giant intracranial
aneurysms: correlation of MR and pathologic findings. Radiology, 162,
111-114.
2. Lawton M. T., Spetzler R. F., 1999, Surgical strategies for giant
intracranial aneurysms. Acta Neurochirurgica, Suppl. 72, 141-156.
3. Pinto R. S. et al, 1979, Correlation of computed tomographic,
angiographic, and neurophatological changes in giant cerebral aneurysms.
Radiology, 132, 85-92, July.






